鎌状赤血球症のCRISPR−Cas9による遺伝子治療効率が24.5%へ上昇!? (2019年最新研究)

ニュース/レビュー
米国のライス大学の研究チームは高精度のCas9を使用して鎌状赤血球症患者からの細胞で遺伝子治療効率を24.5%まで引き上げました。
この研究結果は論文として出版され、その研究レビューが大学サイトに発表されましたので、そのレビューを翻訳しましたのでご紹介します。(翻訳のプロではないので読みづらかったらすみません m(_ _)m )
また発表された論文はオープンアクセスですので、どなたでも無料で論文の全文が閲覧できます!(ただし英語ですが 😅)
→ 最近はGoogle翻訳の性能が良くなって読みやすい日本語に和訳をしてくれますので(完璧ではないですが)ご活用下さい。(Google翻訳はこちら)
新しい遺伝子兵器が鎌状赤血球症に挑戦
Rice 大のlabによるCRISPR-Cas9を利用した戦略は、二面方向から治療に挑戦します。遺伝子編集による原因遺伝子改変と、体内に残っていた胎児型ヘモグロビンの増強によって(生後数ヵ月で発現しなくなるヘモグロビン)、鎌状赤血球症患者を救うことがまもなく可能になるかもしれません。
今回の研究は、患者の造血幹細胞(HSC)の鎌状赤血球変異を修復するために、CRISPR-Cas9と修正用の短いDNAテンプレートを使用することが、効率的かつ安全であることを示しています。
Rice UniversityのBrown School of Engineeringの生体工学者Gang Baoは、Texas Children’s Hospital、Baylor College of Medicine、Stanford Universityと共同で研究を実施しました。この研究のいくつかのひらめきの一つは、Baoと、Baylorの助教でありTexas Children’s Hospitalの鎌状赤血球班の一員でもあるVivien Sheehanによってもたらされました。
研究は、Nucleic Acids Researchのオープンアクセスで発表されています。
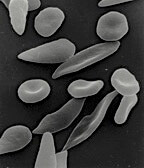
鎌状赤血球症は、約10万人のアメリカ人、また世界では数百万人もの人々が罹患しており、痛みを伴い、しばしば命を落とす遺伝病です。ヘモグロビンのベータサブユニット(βグロビン)の一つの(DNAの)変異が、正常ならば円盤形となる赤血球を硬直させ、特徴的な「鎌状」へ形状を変化させます。これらの細胞は血管壁を傷つけ、小さな血管を凝固させ、組織への酸素の供給を停止させる可能性があります。
今日、この病気に苦しんでいる何人かの人々は、型の合った血縁のドナーから提供された幹細胞で治療されていますが、それが可能なのは患者の15%に満たないのです。望ましい治療は拒絶の危険がなく、理論的にはすべての患者に適応できる患者自身の造血幹・前駆細胞(HSPCs)を改変する方法です。
理想的には、患者の骨髄から単離した幹細胞を遺伝子編集してテストした後、効率よく編集した細胞に置き換わるように、化学療法を施して患者の幹細胞を減らします。その後 編集された細胞を患者に移植し、そこで増殖させることができれば健康な血球を生み出すことができるのです、とBao氏は述べています。
今回の研究では、Baoのチームは初めて、げっ歯類で患者のHSPCsをテストし、遺伝子編集された患者からの細胞の一部が生き残り、約4ヵ月間機能することを実証しました。
これらの幹細胞は、5人の患者の末梢血および2人の患者の骨髄からのもので、Sheehanによって提供されました。
Sheehanの研究室は、編集された細胞によって作られたヘモグロビンのタイプを解析し、遺伝子編集によって保護的で正常なヘモグロビンが生成され、鎌状化を促進する重度の低酸素下であっても、鎌状化を防ぐことを明らかにしました。
化膿レンサ球菌(Streptococcus pyogenes)由来の野生型Cas9タンパク質(DNAの特定の部分を標的とし切断する「はさみ」)を使用した初期の試験では、幹細胞に意図しないDNA編集が多く起きてしまっていました。これらの目的外の編集には、病気を引き起こす可能性のある、染色体の大幅な欠損および逆位が含まれていました。
2回目のテストでは、Riceラボは、Integrated DNA Technologiesによって開発された最新の「高精度 (high-fidelity) Cas9」を採用し、これにより標的外の編集(off-target、オフターゲット)を大幅に減少させることができました。
鎌状変異を有する患者から単離された幹細胞の、全てが遺伝子編集によって編集されるわけではありません。Bao研究室で実験によれば、編集成功率はせいぜい40%でした。他の50%の細胞では、切断されたDNAは導入したDNAテンプレートによって修復はされませんでしたが、幹細胞の胎児ヘモグロビン(HbF)の発現を促進しているようでした。HbFは、鎌状変異を持たない別の遺伝子から生成され、通常は出生後数ヵ月で発現が消失するものです。
胎児ヘモグロビンは鎌状赤血球症の影響を弱めることが知られています。編集細胞での胎児ヘモグロビンの発現が持続するならば、患者からの幹細胞の90%が、鎌状変異が修復されるか、もしくは胎児ヘモグロビンによって鎌状化が防止されるものになる、とBao氏は考えました。
Bao氏は次のように述べています。
「患者の骨髄からHSPCsの一部を取り出し、残りは消失させ、その後HSPCsを編集し患者体内に戻した時、遺伝子修復細胞とHbF発現細胞の組み合わせで、十分に治癒することができるのでは、と期待しています」
幹細胞の10%が鎌状赤血球を産生し続けることは、大きな問題ではないはずだ、とBao氏は言います。
「正常な赤血球は、鎌状赤血球の約9倍の寿命を持っています。時間が経てば、赤血球の大部分は正常細胞であると考えられ、我々にとって望ましい筋書きとなります」
胎児ヘモグロビンレベルを高めるためにβグロビンを(の遺伝子を)切断することが長期的な利益をもたらすのか、それともヘモグロビンの産生を減少させる血液障害である「βサラセミア」を誘発する危険性があるのかどうかはまだ分かりません。
Bao氏は「リスクがあるため、もっとよく調べる必要があります」と話しています。
また、患者に長期的な安心を提供するためには、どれだけの幹細胞を編集しなければならないのかもわかっていません。
「遺伝子編集を行ったHSCの何%が、鎌状赤血球症を効果的に治療できるかはわかっていません。ほんの数パーセントと言う人もいれば、5~10%と言う人もいます。私は5%程度で十分ではないかと思っていますが、正確な割合は臨床試験を行わないと決定できないでしょう」
臨床試験を開始するには、まだ時間がかかるかもしれません。
「技術面では、臨床試験を行う準備ができていますが、承認を得るためには、まだまだ材料が必要です。安全性の問題に対処するには、データをまとめて追加の実験を行う必要があります」と、Bao氏は述べています。
ーーー 翻訳ここまで ーーー
引用ニュース & 原著論文
🔵 英語ニュース:New genetic weapons challenge sickle cell disease(Rice University)🔵 原著論文 :Highly efficient editing of the β-globin gene in patient-derived hematopoietic stem and progenitor cells to treat sickle cell disease, (Nucleic Acids Research, 2019 )
Seigoの追記
遺伝子編集の経験者としてはどんな方法で遺伝子修正をしたのか興味があったので、原著論文からまとめました。βグロビンの遺伝子修正法:high-fidelity SpyCas9とssODNを使用
■
細胞:SCD患者の末梢血または骨髄由来の造血幹細胞および前駆細胞(HSPCs)
■
遺伝子導入方法:エレクトロポレーション(電気穿孔法)
ただ遺伝子導入法がエレクトロポレーションだとショックで死亡する細胞が多く、どうレスキューしたかの方法は論文には記述されていないようでした。
また上記のレビューでは胎児ヘモグロビンの遺伝子切断の話が出ておりましたが、原著論文にはその話はありませんでした。別の論文として発表されたのでしょうか?
鎌形赤血球貧血症をCRISPR/Cas9で治療する研究は数年前から出ておりますが、実際に臨床にまで持っていって成功した話はほとんど出てきません。もっと効率よく遺伝子編集したり移植した細胞を効率よく定着させるところで何か新しい方法を確立する必要があるのかもしれません。
CRIRPR-Cas9(遺伝子編集)関連書籍

20余年アメリカで遺伝子治療&幹細胞の研究者をやってきました。
特に遺伝病の間違った遺伝子をピンポイントで修復し、元に戻す技術開発です。
理学博士(Ph.D. )
アメリカ生活で学んだアンチエイジングなど健康に関する知識をシェアしたいと思います。
巷の情報もご紹介、時にはブッた斬ったりしてしまうかもしれません。
またポイントなどの節約術や生活に便利なガジェット(スマホやアプリの紹介)も記事にしますので参考になれば嬉しいです。
皆さん、ご一緒に「究極のヘルシーライフ」を楽しみましょう♪
《もっとくわしいプロフィールをみる》




































この記事へのコメントはありません。