ゲノム編集(クリスパーキャス9)を医療へ応用: 造血幹細胞への影響・最適化

ニュース/レビュー
・今回はNature Medicine に発表された造血幹細胞へのゲノム編集の論文をScienceDailyがレビュー(英語)しておりました。
今回はそのレビューを翻訳しましたので、ここでお知らせいたします。
この記事のもくじ
科学ニュース「研究者はSCDとベータサラセミアの遺伝子編集を最適化」

鎌形赤血球貧血症(SCD)の赤血球像(出典:By NIDDK – (US government agency), The photo is attributed to Drs. Noguchi, Rodgers, and Schechter of NIDDK., Link )
副題:血液幹細胞を編集するための新しい戦略はより効率的でターゲットを絞っています
日付:2019年3月28日
情報源:ボストン小児病院
概要:患者の造血幹細胞の遺伝子編集は潜在的に多くの血液疾患を治療することができます。 しかし、これらの細胞に的を絞った(ゲノム)編集を導入することは困難であり、細胞が骨髄に生着した後は編集が常に安定するとは限りません。 研究者らは現在、これらの技術的課題を克服するためのCRISPRを使ったアプローチを報告しています。
ダナファーバー / ボストンがん研究所(Researchers at Dana-Farber/Boston)の小児がん血液疾患センター(Children’s Cancer and Blood Disorders Center)およびマサチューセッツ大学医学部(University of Massachusetts Medical School)の研究者らは、最も一般的な2つの遺伝性の血液疾患 — 即ち、1つに鎌状赤血球症(SCD)および2つにベータサラセミア貧血症(β-thalassemia)— をCRISPR-Cas9ゲノム編集技術を活用して治療する方法を開発しました。これらのアプローチは、今週のNature Medicine 誌とBlood 誌の1月号に、患者自身の造血幹細胞を、より効率的に編集することによって、過去の技術的な課題を克服するものとして紹介されています。
これら2つの研究から、遺伝子編集された細胞が、遺伝子操作された赤血球を生成して機能的ヘモグロビンを産生することが明らかになりました。
ダナファーバー / ボストンがん研究所の主任医師で、これら2つの論文両方のシニアオーサー(リーダー)であるダニエルバウアー(Daniel Bauer)博士は、「私たちの研究は、一般的なヘモグロビン障害の治療につながる戦略を定義付けたものと考えています」として「遺伝子編集と自家幹細胞移植を組み合わせることは、鎌状赤血球症、β-サラセミア、その他の血液疾患の治療法としての可能性があります。」と述べています。
世界保健機関(WHO)によると、鎌状赤血球症とβ-サラセミアは合わせて、毎年世界中で332,000例の妊娠または出生に影響を及ぼしています。どちらの疾患もベータグロビンタンパク質の遺伝子に変異があります。β-サラセミアでは、この変異は赤血球が十分な酸素運搬ヘモグロビン分子を産生するのを妨げ、依って貧血を引き起こします。鎌状赤血球症は、ヘモグロビンに変形をもたらし、赤血球の鎌状形を硬化し、これが血管閉塞の原因になります。
より効率的な(ゲノム)編集
Nature Medicine 誌がCRISPR-Cas9、特にウルフ博士率いるマサチューセッツ大学医学部チームによって編集最適化されたCas9タンパク質技術を取り上げて掲載しています。ヒトの造血幹細胞および前駆細胞のゲノムを編集することについて、以前の試みでは細胞が骨髄に移植された後の編集の効率、特異性および長期安定性にはばらつきがありました。新しいテクニックでは編集ターゲットの設定と耐久性が改善されています。マサチューセッツ大学医学部、分子・細胞・がん生物学科のウルフ教授は、「患者にとって永続的な治療効果を得るためには、造血幹細胞集団を効率的に編集することが必要です。」として、「この目標に向けての進歩は、科学界の複数の研究室の貢献によってもたらされてきました。私の研究チームは、バウアー研究室(Bauer laboratory)と共同して、この目標をほぼ完全を達成すべく、全血幹細胞集団の治療的編集を行うに、CRISPR-Cas9技術のデリバリー効率および核内エントリーの向上に焦点を合わせました」と述べています。
バウアー研究室のチームは、この方法を使ってターゲットを絞った編集を行いました。ボストンの小児がんセンターにおけるこれまでの研究から、BCL11Aと呼ばれる遺伝子を不活性化すると、赤血球が胎児型のヘモグロビンを出生後も産生し続けることを可能にすることが判明しました。胎児型ヘモグロビンは鎌状化せず、欠陥のある「成人」ヘモグロビンの代わりになることが可能です。最近になって、バウアー研究室はより安全な標的、すなわち赤血球においてのみ活性であるBCL11Aの遺伝子エンハンサーを発見しました。
バウアー氏は、「私たちの新しい非常に効率的なプロトコールにより、私たちが集めるほぼすべての造血幹細胞でBCL11Aエンハンサーを編集することが可能であり、これらの細胞を編集するについての技術的課題のいくつかを克服しました」として「我々の実験では、エンハンサー配列の95%以上のコピーが治療効果が上がると期待された方法で変化しました」と述べています。
この治療戦略では、鎌状赤血球症患者からの造血幹細胞を持つマウスが、細胞鎌状化を防ぐのに十分な胎児ヘモグロビンを有する赤血球を産生することができました。チームは、遺伝子編集された細胞が血流に注入され、骨髄に生着し、そして遺伝的に修正された赤血球を生成することを示しました。後に、造血幹細胞がこれらのマウスから単離され、そして他のマウスに移植されたとき、細胞は再び生着し、依然として治療的遺伝子変化を保有していました。
β-サラセミア患者からの造血幹細胞に適用されて、同じ戦略はヘモグロビンを構成するグロビン鎖の正常なバランスを回復しました。
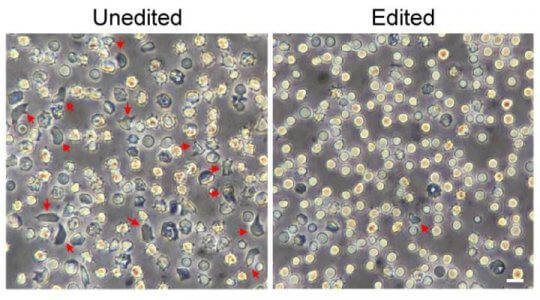
左側の編集されていない赤血球(Unedited)には、赤い矢印で示されているように、形の悪い “鎌状赤血球”が多数含まれています。 これらは、遺伝子編集(Edited; 右の写真)された造血幹細胞によって作られた赤血球ではほとんど消えていました。Credit: Daniel Bauer/Boston Children’s Hospital
Blood 誌に発表されたもう一つの研究は、スプライシング突然変異を含むβ-サラセミアの形態 — 即ち、β-グロビン蛋白質の組み合わせが如何に変化するかを読み取るβ-グロビン遺伝子の近くにあるDNAビットの欠陥を標的とすべく、同様の遺伝子編集プロトコールを使用しました。この研究では、9人のベータサラセミア患者が細胞を提供し、それを培養皿の中で操作しました。マサチューセッツ大医学部チームは、何人かの患者の突然変異をより効果的に標的とする酵素、Cas12aを作り出しました。CRISPRシステムは効率的に編集を行いそして各患者からの血球中のβ-グロビンタンパク質の正常なスプライシングを回復しました。
臨床試験のステージ設定
研究者達は彼らのBCL11Aエンハンサー編集戦略を診療所に持ち込むための措置を講じている。彼らは、臨床用グレードの細胞製品製造のためのスケールアップされたプロトコールを開発しており、そしてFDAからの規制当局の承認に必要な安全性試験を実施している。彼らは、国立心臓、肺および血液研究所のCure Sickle Cellイニシアチブから、患者で臨床試験を開始するための資金提供を求める予定です。ダナファーバー / ボストン小児がん研究所は既に鎌状赤血球症の遺伝子治療の臨床試験を始めています。そのアプローチは、患者の造血幹細胞を赤血球前駆体内のBCL11A 遺伝子を壊すためのプログラムを運ぶレンチウイルスに感染させることによって、胎児型ヘモグロビンの産生を増加させます。
バウアー氏は、それらの両方のアプローチを追求し続けることが重要であると考えています。彼は、「これらの症状は非常に一般的な遺伝性疾患であり、資源が非常に限られている世界の一部で特に頻繁に発生します」として、「そのため、できるだけ多くの患者さんに治療を受けられるようにするには、幅広い治療の選択肢が必要です。」と述べています。
ダナファーバー / ボストン小児がん研究所のYuxuan Wu氏とJing Zeng氏は、Nature Medicine誌掲載記事の主幹執筆者で、バウアー氏はその共同執筆者です。ダナファーバー / ボストン小児がん研究所のShuqian Xu氏は、Blood 誌掲載記事の主幹執筆者で、バウアー氏とウルフ氏がその共同執筆者です。
この研究は、ボストン小児病院(Boston Children’s Hospital)、国立衛生研究所(National Institutes of Health/NHLBI、NHGRI、NIAID、NIGMS、NIDDK)のトランスレーショナルリサーチプログラム、ハーバード幹細胞研究所(the Harvard Stem Cell Institute)、セントジュード小児研究病院共同研究コンソーシアム(St. Jude Children’s Research Hospital Collaborative Research Consortium バロウズウェルカムファンド(Burroughs Wellcome Fund)、アメリカ血液学会(American Society of Hematology)およびドリスデュークチャリティブル(Doris Duke Charitable)、チャールズHフッドおよびクーリー貧血治療財団(Charles H. Hood and Cooley’s Anemia Foundations.)によって支援されました。
ボストンチルドレンズホスピタルは、ブルーバードバイオの株式保有者であり、何人かの著者が治療用遺伝子編集に関する特許を申請しています。
研究されている技術が有益であると判明した場合、ボストン小児病院は経済的利益を得ることができます。すべての研究と同様に、病院は、研究対象の安全性、およびこの研究によって得られた情報の妥当性と完全性を確保するために必要なすべての措置を講じており、今後も続けていきます。
引用ニュース & 原著論文
🔵 ニュース記事(英語):Researchers optimize gene editing for SCD and beta thalassemia (ScienceDaily) March 28, 2019🔵 原著論文 : Highly efficient therapeutic gene editing of human hematopoietic stem cells, Nature Medicine (2019).
ゲノム編集の関連書籍
■

(書籍の上をクリック/タップするとAmazonの商品ページへ行くようにリンクを貼っておきました)
Seigoの追記
これはゲノム編集技術の「遺伝子を壊す性質」をうまく利用して造血系に異常のある遺伝子疾患の幹細胞に適用させている。鎌形赤血球貧血症やβサラセミアはβ-グロビン遺伝子に異常がある遺伝子疾患であるが、(そのβ-グロビン遺伝子自体を直接治すのはまだ効率が悪いので)それ以外の方法を使ってグロビンを復活させようとしている、頭の良いやり方である。
早くうまくいって遺伝病の患者さんの苦しみが少しでも軽減できることを願うばかりです!

20余年アメリカで遺伝子治療&幹細胞の研究者をやってきました。
特に遺伝病の間違った遺伝子をピンポイントで修復し、元に戻す技術開発です。
理学博士(Ph.D. )
アメリカ生活で学んだアンチエイジングなど健康に関する知識をシェアしたいと思います。
巷の情報もご紹介、時にはブッた斬ったりしてしまうかもしれません。
またポイントなどの節約術や生活に便利なガジェット(スマホやアプリの紹介)も記事にしますので参考になれば嬉しいです。
皆さん、ご一緒に「究極のヘルシーライフ」を楽しみましょう♪
《もっとくわしいプロフィールをみる》
































この記事へのコメントはありません。