認知症予防に重要!? タンパク質変性を防ぐ仕組みが細胞の核の中で見つかった (2019年最新研究)
ニュース/レビュー
目立たない存在の核小体ですが、このたびタンパク質の凝集を防ぐという新しい機能が発見され Science 誌に発表されました。
これはドイツのマックスプランク研究所からの報告で、この研究のレビュー記事(英語)はミュンヘン大学のサイトで発表されました。そのレビュー記事を翻訳しましたので紹介いたします。(翻訳のプロではないので読みづらかったらすみません m(_ _)m )
細胞核の新しい機能
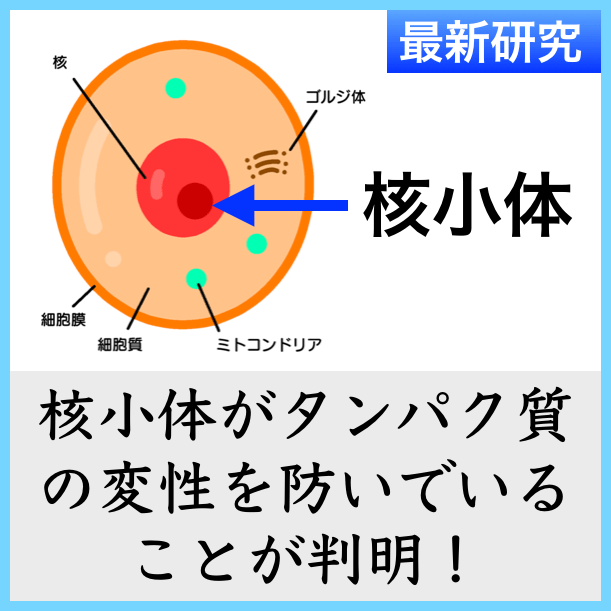
核小体は、光学顕微鏡下で容易に観察できる、細胞核内の構造物です。この核構造は、リボソーム産生の部位であることが知られていますが、今回、核小体もタンパク質の品質管理の場であることが示されました。細胞がストレスを受けると、タンパク質はミスフォールドして凝集する傾向があります。タンパク質の凝集を防ぐために、一部は核小体に一時的に保存されます。この細胞小器官に見られる特別な生物物理学的な働きによって、有害なタンパク質の凝集が阻止されます。
このことは、マックスプランク研究所(MPI)の分子イメージングおよびバイオナノテクノロジーグループのリーダーである、 LMU実験物理学のRalf Jungmann教授、及び、 MPI for Biochemistry所属のF.-Ulrich HartlとMark Hippの両者によって示され、サイエンス誌に発表されました。
核小体は、1830年代に初めて記載された、細胞核に見られる構造体です。1960年代に、細胞のタンパク質工場であるリボソームがこの細胞小器官に集合することが見出されました。程なく、シャペロン*タンパク質が特定の状況下で核小体に移動することが発見され、この移動は、タンパク質産生に関連しているものと考えられてきました。
〔※注釈:シャペロンとは、折りたたまれていない(変性状態の)タンパク質に結合し、それが適切に折りたたまれた状態(天然状態)になるのを助けるタンパク質の総称である[2]。ウィキペディアより〕
ところが、今回の研究では、核小体に移動するシャペロンが、すでにストレス感受性タンパク質に結合していることが示されたのです。
シャペロン研究の先駆者として、F.-Ulrich Hartlと彼のチームは以前、シャペロンがタンパク質の正しいフォールディングにとって重要であり、タンパク質品質管理において中心的な役割を果たすことを発見していました。ミスフォールドされたタンパク質は凝集する恐れがありますが、そのような凝集体は、アルツハイマー病、パーキンソン病またはハンチントン病などの神経変性疾患においてしばしば観察されるものです。
Ulrich Hartlと同じ学科に所属し、論文の責任者であるMark Hippは次のように述べています。
「我々は、タンパク質フォールディングのメカニズムを調べるためのモデルタンパク質として、酵素ルシフェラーゼを長年使用してきました。酵素と蛍光タンパク質に融合させると、顕微鏡下で追跡することができ、タンパク質のフォールディングが正しいか誤っているか、凝集体を形成しているか、観察することができます。細胞を43℃に加熱してストレスを加えると、ミスフォールドしたルシフェラーゼタンパク質が、シャペロンとともに核小体に輸送されることを示しました」
このプロセスの機構的な詳細を解明するため、多数の高分解能蛍光技術を開発したRalf Jungmannと、新規バイオインフォマティクス分析法に貢献したJürgenCox(MPI for Biochemistry所属)が率いるグループの協力を仰ぎました。共同研究の結果、ミスフォールドルシフェラーゼタンパク質が、核小体内で細胞の他の部分とは異なる挙動をすることが示されました。
筆頭著者のFrédéric Frottinは、「核小体では、誤って折り畳まれたタンパク質は凝集するのではなく液体のような状態に保たれていました。これは細胞小器官内に広がる、特定の生物物理学的条件によって可能になっています。通常凝集する傾向があるタンパク質は、ストレスの際に危険性の低い形で保存され、細胞を損傷から守ります。細胞が回復する時間があれば、タンパク質は正しくフォールディングし直されて、核小体から放出されます」と説明しています。
この段階では、細胞はタンパク質を修復するか、分解するか、どちらかを行う機構を活性化させる可能性を残しています。細胞ストレスが長すぎると、この保護メカニズムが機能しないことも示しました。
Mark Hippは、「これは細胞の完全性を維持する新しい機構です」と話しています。
この完全性を保持することは、病気の発症を抑制し、老化プロセスを遅らせるのに不可欠な要素なのです。
ーーー 翻訳ここまで ーーー
引用ニュース&原著論文
🔵 英語ニュース:New function for the nucleolus(Ludwig Maximilian University of Munich)7/16/2019🔵 原著論文 : The nucleolus functions as a phase-separated protein quality control compartment (Science, 2019 )
Seigoの追記
核小体は核の中にある小さな密度の濃い部分で、リボソームなどを作っている場所として高校生の時に習っているかもしれません。その核小体がストレスがかかった時にタンパク質を保護していたとは知りませんでした。
特にもとに戻らなくなるようなタンパク質の凝集をそこで防いでいるようです。
もしタンパク質が凝集してしまうと、アルツハイマー病、パーキンソン病またはハンチントン病などにみられるような細胞のゴミが貯まってしまって認知症に導くような悪さをしてしまう可能性があるとのことです。
タンパク質の凝集が起こらないようにすれば上記のような病気は防げる可能性があるので、ぜひ研究を進めていってもらいたいものです。
原著論文のアブストラクトを読みますとHsp70という分子が核小体で大活躍をしているみたいですね。以下にHspに関連する書籍のリンクを貼っておきます。

20余年アメリカで遺伝子治療&幹細胞の研究者をやってきました。
特に遺伝病の間違った遺伝子をピンポイントで修復し、元に戻す技術開発です。
理学博士(Ph.D. )
アメリカ生活で学んだアンチエイジングなど健康に関する知識をシェアしたいと思います。
巷の情報もご紹介、時にはブッた斬ったりしてしまうかもしれません。
またポイントなどの節約術や生活に便利なガジェット(スマホやアプリの紹介)も記事にしますので参考になれば嬉しいです。
皆さん、ご一緒に「究極のヘルシーライフ」を楽しみましょう♪
《もっとくわしいプロフィールをみる》







































この記事へのコメントはありません。